Ujian Akhir Semester (UAS) adalah momen penting bagi setiap siswa untuk mengevaluasi pemahaman mereka terhadap materi yang telah dipelajari selama satu semester. Untuk mata pelajaran Kimia Kelas 10 Kurikulum 2013 Semester 1, ada beberapa konsep fundamental yang menjadi inti pembelajaran. Artikel ini akan menyajikan contoh soal beserta pembahasannya, dirancang untuk membantu siswa mempersiapkan diri menghadapi UAS dengan lebih baik.
Outline Artikel:
- Pendahuluan: Pentingnya UAS Kimia Semester 1 dan materi yang dicakup.
- Materi Kimia Kelas 10 Semester 1 K13:
- Struktur Atom
- Sistem Periodik Unsur
- Ikatan Kimia
- Tata Nama Senyawa
- Hukum Dasar Kimia dan Konsep Mol
- Contoh Soal dan Pembahasan:
- Bagian 1: Struktur Atom
- Bagian 2: Sistem Periodik Unsur
- Bagian 3: Ikatan Kimia
- Bagian 4: Tata Nama Senyawa
- Bagian 5: Hukum Dasar Kimia dan Konsep Mol
- Strategi Menghadapi UAS Kimia: Tips belajar efektif.
- Penutup: Motivasi dan harapan.
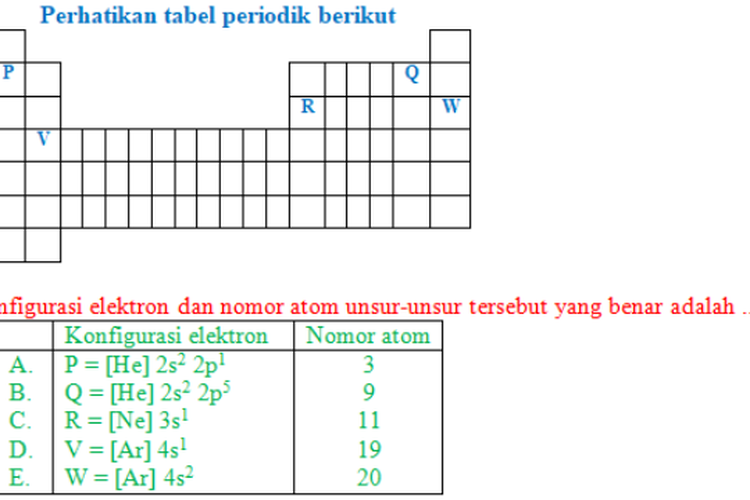
>
1. Pendahuluan
Kimia adalah ilmu yang mempelajari materi dan perubahannya. Di Kelas 10 Semester 1 Kurikulum 2013, siswa diajak untuk memahami dasar-dasar kimia yang menjadi fondasi bagi materi yang lebih kompleks di jenjang selanjutnya. Materi yang diajarkan meliputi struktur atom, sistem periodik unsur, ikatan kimia, tata nama senyawa, serta hukum dasar kimia dan konsep mol. Memahami konsep-konsep ini secara mendalam sangat krusial untuk sukses dalam UAS. Artikel ini akan memberikan gambaran soal-soal tipikal yang mungkin muncul, lengkap dengan pembahasannya, agar siswa memiliki panduan belajar yang terarah.
2. Materi Kimia Kelas 10 Semester 1 K13
Sebelum masuk ke contoh soal, mari kita ulas singkat materi-materi kunci yang menjadi fokus di semester 1:
- Struktur Atom: Mempelajari partikel penyusun atom (proton, neutron, elektron), nomor atom, nomor massa, isotop, isoton, isobar, serta konfigurasi elektron berdasarkan kulit atom.
- Sistem Periodik Unsur: Memahami sejarah perkembangan SPU, pengelompokan unsur (golongan dan periode), serta sifat-sifat keperiodikan unsur (jari-jari atom, energi ionisasi, afinitas elektron, keelektronegatifan).
- Ikatan Kimia: Mempelajari berbagai jenis ikatan (ion, kovalen, logam), proses pembentukannya, kaidah oktet, dan struktur Lewis sederhana.
- Tata Nama Senyawa: Aturan penamaan senyawa ionik (biner, poliatomik), senyawa kovalen biner, dan senyawa asam.
- Hukum Dasar Kimia dan Konsep Mol: Meliputi Hukum Lavoisier (kekekalan massa), Hukum Proust (perbandingan tetap), Hukum Dalton (perbandingan berganda), Hukum Gay-Lussac (perbandingan volume), Hukum Avogadro, serta konsep mol, massa molar, dan volume molar gas.
3. Contoh Soal dan Pembahasan
Berikut adalah contoh soal-soal kimia untuk UAS Semester 1 Kelas 10 Kurikulum 2013 beserta pembahasannya yang detail.
>
Bagian 1: Struktur Atom
Soal 1:
Suatu unsur X memiliki nomor atom 17 dan nomor massa 35. Tentukan jumlah proton, elektron, dan neutron dalam atom netral unsur X tersebut!
Pembahasan:
- Nomor Atom (Z) menunjukkan jumlah proton dalam inti atom. Untuk atom netral, jumlah proton sama dengan jumlah elektron.
- Nomor Massa (A) adalah jumlah proton dan neutron dalam inti atom.
Dari soal:
- Nomor atom (Z) = 17
- Nomor massa (A) = 35
Maka:
- Jumlah proton = Z = 17
- Jumlah elektron = jumlah proton (untuk atom netral) = 17
- Jumlah neutron = A – Z = 35 – 17 = 18
Jadi, atom X memiliki 17 proton, 17 elektron, dan 18 neutron.
>
Soal 2:
Tuliskan konfigurasi elektron atom K (Kalium) dengan nomor atom 19 berdasarkan model kulit atom (Bohr)! Tentukan pula letak golongan dan periode unsur Kalium dalam sistem periodik!
Pembahasan:
Konfigurasi elektron berdasarkan model kulit atom mengisi elektron mulai dari kulit K, L, M, N, dan seterusnya dengan kapasitas maksimal 2, 8, 18, 32 elektron secara berurutan.
Untuk atom K dengan nomor atom 19:
- Kulit K: 2 elektron
- Kulit L: 8 elektron
- Kulit M: 8 elektron (sisa 19 – 2 – 8 = 9 elektron, namun kulit terluar tidak boleh lebih dari 8 elektron jika bukan kulit terakhir yang dapat menampung 18, jadi 8 dulu)
- Kulit N: 1 elektron (sisa 9 – 8 = 1 elektron)
Jadi, konfigurasi elektron K adalah 2 . 8 . 8 . 1.
Letak dalam sistem periodik:
- Periode: Ditentukan oleh jumlah kulit yang terisi elektron. Atom K memiliki 4 kulit yang terisi (K, L, M, N), sehingga berada pada Periode 4.
- Golongan: Ditentukan oleh jumlah elektron valensi (elektron pada kulit terluar). Atom K memiliki 1 elektron valensi, sehingga berada pada Golongan IA.
>
Bagian 2: Sistem Periodik Unsur
Soal 3:
Diketahui unsur-unsur dengan konfigurasi elektron sebagai berikut:
P: 2.8.1
Q: 2.8.7
R: 2.8.2
S: 2.8.6
T: 2.8.8.1
Urutkan unsur-unsur tersebut berdasarkan kenaikan jari-jari atom! Jelaskan alasannya!
Pembahasan:
- Jari-jari atom adalah jarak dari inti atom ke kulit elektron terluar.
- Dalam satu periode (baris), dari kiri ke kanan, jari-jari atom cenderung berkurang karena muatan inti positif bertambah, menarik elektron lebih kuat ke arah inti, sementara jumlah kulit tetap.
- Dalam satu golongan (kolom), dari atas ke bawah, jari-jari atom cenderung bertambah karena jumlah kulit elektron bertambah.
Mari kita tentukan golongan dan periode masing-masing unsur:
- P (2.8.1): Golongan IA, Periode 3
- Q (2.8.7): Golongan VIIA, Periode 3
- R (2.8.2): Golongan IIA, Periode 3
- S (2.8.6): Golongan VIA, Periode 3
- T (2.8.8.1): Golongan IA, Periode 4
Unsur P, Q, R, S berada pada periode yang sama (Periode 3). Dalam satu periode, jari-jari atom berkurang dari kiri ke kanan. Jadi, urutan jari-jari atom dari terbesar ke terkecil untuk P, Q, R, S adalah R > P > S > Q.
Unsur T berada pada periode 4, yang berarti memiliki kulit elektron lebih banyak dibandingkan unsur-unsur di periode 3. Oleh karena itu, T akan memiliki jari-jari atom yang paling besar.
Jadi, urutan unsur berdasarkan kenaikan jari-jari atom adalah:
Q < S < P < R < T
Alasan:
Unsur Q, S, P, R berada dalam Periode 3. Semakin ke kanan dalam satu periode, muatan inti efektif semakin besar sehingga tarikan inti terhadap elektron terluar semakin kuat, menyebabkan jari-jari atom semakin kecil. Oleh karena itu, Q (Gol VIIA) memiliki jari-jari terkecil di antara mereka, dan R (Gol IIA) terbesar. Unsur T berada pada Periode 4, yang berarti memiliki satu kulit elektron lebih banyak dibandingkan unsur-unsur di Periode 3, sehingga jari-jari atom T paling besar.
>
Bagian 3: Ikatan Kimia
Soal 4:
Gambarkan struktur Lewis untuk molekul H2O (air)! Tentukan pula jenis ikatan yang terjadi antara atom H dan O! (Nomor atom H=1, O=8)
Pembahasan:
Langkah-langkah menggambar struktur Lewis:
- Tentukan elektron valensi masing-masing atom.
- H (Z=1): Konfigurasi elektron = 1. Elektron valensi = 1.
- O (Z=8): Konfigurasi elektron = 2.6. Elektron valensi = 6.
- Tentukan atom pusat (biasanya atom yang paling sedikit atau yang kurang elektronegatif, kecuali H). Dalam H2O, O adalah atom pusat.
- Hitung total elektron valensi = (2 × 1) + 6 = 8 elektron.
- Letakkan atom pusat dan sekelilingnya, lalu ikatkan dengan ikatan tunggal.
H – O – H
(Sudah terpakai 2 pasang elektron = 4 elektron) - Sisa elektron = 8 – 4 = 4 elektron. Letakkan sisa elektron sebagai pasangan elektron bebas pada atom pusat (atau atom yang belum oktet). Atom O membutuhkan 4 elektron lagi untuk mencapai oktet (8 – 4 = 4).
Struktur Lewis H2O:
..
H - O - H
¨¨(Dua pasang elektron bebas pada atom O, dan masing-masing H berbagi 1 pasang elektron dengan O)
Jenis ikatan yang terjadi:
Antara atom H dan O terjadi ikatan kovalen. Hal ini karena ikatan terbentuk antara dua unsur non-logam (H dan O), di mana mereka mencapai kestabilan dengan cara berbagi elektron. Karena perbedaan keelektronegatifan antara O dan H cukup signifikan (O lebih elektronegatif), elektron ikatan akan lebih tertarik ke arah O, sehingga ikatan kovalen ini bersifat polar.
>
Soal 5:
Pasangan unsur berikut yang dapat membentuk ikatan ion adalah…
A. C dan O
B. N dan H
C. K dan Cl
D. S dan O
E. H dan I
Pembahasan:
Ikatan ion terbentuk antara atom logam (cenderung melepas elektron membentuk kation) dan atom non-logam (cenderung menerima elektron membentuk anion). Perbedaan keelektronegatifan antara keduanya sangat besar.
Mari kita analisis setiap pilihan:
- A. C dan O: Keduanya non-logam. Membentuk ikatan kovalen (contoh: CO2).
- B. N dan H: Keduanya non-logam. Membentuk ikatan kovalen (contoh: NH3).
- C. K dan Cl: K (Kalium) adalah logam Golongan IA. Cl (Klorin) adalah non-logam Golongan VIIA. K cenderung melepas 1 elektron, Cl cenderung menerima 1 elektron. Mereka akan membentuk K+ dan Cl-, berikatan ionik (KCl).
- D. S dan O: Keduanya non-logam. Membentuk ikatan kovalen (contoh: SO2, SO3).
- E. H dan I: Keduanya non-logam. Membentuk ikatan kovalen (contoh: HI).
Jadi, pasangan unsur yang dapat membentuk ikatan ion adalah C. K dan Cl.
>
Bagian 4: Tata Nama Senyawa
Soal 6:
Berikan nama untuk senyawa-senyawa berikut:
a. CaCl2
b. N2O4
c. Fe2(SO4)3
d. H2SO4 (larutan)
Pembahasan:
a. CaCl2: Ini adalah senyawa ionik yang terbentuk dari logam Kalsium (Ca) dan non-logam Klorin (Cl). Ca adalah logam Golongan IIA, sehingga muatannya selalu +2. Cl adalah anion klorida.
Nama: Kalsium Klorida
b. N2O4: Ini adalah senyawa kovalen biner yang terbentuk dari dua non-logam (Nitrogen dan Oksigen). Untuk senyawa kovalen biner, digunakan awalan Yunani untuk menunjukkan jumlah atom.
- N2: dinitrogen
- O4: tetraoksida (huruf ‘a’ pada tetra biasanya dihilangkan jika bertemu vokal ‘o’)
Nama: Dinitrogen Tetraoksida
c. Fe2(SO4)3: Ini adalah senyawa ionik yang melibatkan logam transisi (Besi, Fe) dan ion poliatomik (Sulfat, SO4^2-). Karena Fe adalah logam transisi, muatannya dapat bervariasi, sehingga perlu dicantumkan bilangan oksidasinya dalam angka Romawi.
Ion sulfat (SO4) memiliki muatan -2. Karena ada 3 ion sulfat, total muatan negatif adalah 3 × (-2) = -6.
Untuk menyeimbangkan, total muatan positif dari 2 atom Fe harus +6, sehingga setiap atom Fe memiliki muatan +3.
Nama: Besi(III) Sulfat
d. H2SO4 (larutan): Ini adalah senyawa asam. Asam yang mengandung oksigen (asam oksi) diberi nama dengan akhiran "-at" atau "-it" dari anionnya. Anion SO4^2- adalah sulfat.
Nama: Asam Sulfat
>
Soal 5: Tuliskan rumus kimia dari senyawa-senyawa berikut:
a. Kalium Nitrat
b. Karbon Disulfida
c. Tembaga(II) Oksida
Pembahasan:
a. Kalium Nitrat:
- Kalium (K) adalah logam Golongan IA, membentuk ion K+.
- Nitrat adalah ion poliatomik NO3-.
- Untuk menyeimbangkan muatan (+1 dan -1), diperlukan 1 ion K+ dan 1 ion NO3-.
Rumus kimia: KNO3
b. Karbon Disulfida:
- Ini adalah senyawa kovalen karena melibatkan dua non-logam (Karbon dan Sulfur) dan menggunakan awalan Yunani.
- Karbon (C) tanpa awalan berarti 1 atom.
- Disulfida berarti 2 atom Sulfur (S).
Rumus kimia: CS2
c. Tembaga(II) Oksida:
- Tembaga (Cu) adalah logam transisi. Angka Romawi (II) menunjukkan muatan ion Tembaga adalah +2 (Cu^2+).
- Oksida adalah ion O^2-.
- Untuk menyeimbangkan muatan (+2 dan -2), diperlukan 1 ion Cu^2+ dan 1 ion O^2-.
Rumus kimia: CuO
>
Bagian 5: Hukum Dasar Kimia dan Konsep Mol
Soal 8:
Sebanyak 10 gram gas hidrogen (H2) direaksikan dengan sejumlah gas oksigen (O2) menghasilkan 90 gram air (H2O). Berapa massa gas oksigen yang bereaksi? (Hukum Lavoisier)
Pembahasan:
Hukum Lavoisier (Hukum Kekekalan Massa) menyatakan bahwa massa zat sebelum dan sesudah reaksi adalah sama.
Massa reaktan = Massa produk
Massa H2 + Massa O2 = Massa H2O
Diketahui:
- Massa H2 = 10 gram
- Massa H2O = 90 gram
Maka:
10 gram + Massa O2 = 90 gram
Massa O2 = 90 gram – 10 gram
Massa O2 = 80 gram
Jadi, massa gas oksigen yang bereaksi adalah 80 gram.
>
Soal 9:
Berapa jumlah mol dari 49 gram asam sulfat (H2SO4)? (Ar H=1, S=32, O=16)
Pembahasan:
Langkah pertama adalah menghitung Massa Molar (Mr) dari H2SO4.
Mr H2SO4 = (2 × Ar H) + (1 × Ar S) + (4 × Ar O)
Mr H2SO4 = (2 × 1) + (1 × 32) + (4 × 16)
Mr H2SO4 = 2 + 32 + 64
Mr H2SO4 = 98 g/mol
Kemudian, gunakan rumus mol:
Mol = Massa / Mr
Mol = 49 gram / 98 g/mol
Mol = 0,5 mol
Jadi, jumlah mol dari 49 gram asam sulfat adalah 0,5 mol.
>
Soal 10:
Berapa jumlah molekul yang terdapat dalam 0,2 mol gas CO2? (Bilangan Avogadro = 6,02 x 10^23 molekul/mol)
Pembahasan:
Jumlah molekul dapat dihitung dengan mengalikan jumlah mol dengan bilangan Avogadro.
Jumlah molekul = Mol × Bilangan Avogadro
Jumlah molekul = 0,2 mol × 6,02 × 10^23 molekul/mol
Jumlah molekul = 1,204 × 10^23 molekul
Jadi, dalam 0,2 mol gas CO2 terdapat 1,204 × 10^23 molekul.
>
4. Strategi Menghadapi UAS Kimia
Untuk menghadapi UAS Kimia dengan percaya diri, terapkan strategi berikut:
- Pahami Konsep Dasar: Jangan hanya menghafal, tetapi pahami "mengapa" dan "bagaimana" suatu konsep bekerja. Misalnya, mengapa jari-jari atom mengecil dalam satu periode atau mengapa ikatan ion terbentuk.
- Latihan Soal Secara Rutin: Semakin banyak berlatih soal, semakin terbiasa dengan berbagai tipe pertanyaan dan cara penyelesaiannya. Gunakan buku paket, LKS, atau sumber online sebagai referensi.
- Buat Ringkasan Materi: Catat poin-point penting dari setiap bab, rumus-rumus, dan contoh aplikasinya. Ringkasan ini akan sangat membantu saat melakukan review cepat sebelum ujian.
- Diskusi Kelompok: Belajar bersama teman dapat membantu mengklarifikasi konsep yang sulit dan bertukar ide dalam menyelesaikan soal.
- Manfaatkan Guru: Jangan ragu bertanya kepada guru jika ada materi atau soal yang tidak dimengerti.
- Jaga Kesehatan: Pastikan tidur cukup dan makan makanan bergizi. Kondisi fisik yang prima akan mendukung konsentrasi saat ujian.
- Teliti Membaca Soal: Pahami setiap detail pertanyaan, apa yang diminta, dan data apa saja yang diberikan.
5. Penutup
Persiapan yang matang adalah kunci keberhasilan dalam UAS. Dengan memahami materi secara menyeluruh, rajin berlatih soal, dan menerapkan strategi belajar yang efektif, Anda akan lebih siap menghadapi ujian kimia. Ingatlah bahwa setiap usaha yang Anda lakukan akan berbuah hasil. Tetap semangat, fokus, dan raih nilai terbaik!

